Математика подскажет, как лечить рак мочевого пузыря
Ученые Физтеха с коллегами из Санкт-Петербурга и Израиля проанализировали более 500 ранее опубликованных научных статей и предложили подход к выбору методики лечения одного из распространенных видов рака. Подробности опубликованы в обзоре на страницах International Journal of Cancer.
Исследователи из МФТИ, Санкт-Петербургского государственного педиатрического медицинского университета и Ариэльского универитета Израиля предложили использовать для принятия решения клинические данные о концентрации определенных белков (биомаркеров). Разработанные командой математические модели позволяют при помощи этой информации сделать выбор между консервативным (без операции) и радикальным (хирургическим) вмешательством. Более того, авторы считают, что предложенный подход позволит выбрать оптимальный курс лечения для каждого пациента.
Рак мочевого пузыря - одно из самых распространенных онкологических заболеваний; статистика показывает, что этой форме рака подвержены 1 из 26 мужчин и 1 из 90 женщин. В России число заболевших оценивается в 12500 ежегодно, и поэтому проблема правильного лечения и аккуратной диагностики стадии рака важна как с научной, так и с клинической точки зрения.
При правильной диагностике и своевременном обнаружении неинвазивный (см. ниже) рак мочевого пузыря успешно лечится. Опухоль практически всегда начинает расти в слое клеток, который выстилает этот орган изнутри - эпителии - и если она не успевает затронуть мышечный слой, то ее удается удалить с минимальным риском рецидивов. Но если опухоль проникла в мышцу мочевого пузыря, то такой рак называют мышечно-инвазивным, он гораздо активнее дает метастазы и шансы на благополучное излечение резко падают. Сегодня пятилетняя выживаемость при мышечно-инвазивном раке мочевого пузыря составляет от 30 до 50% - эти цифры обозначают число пациентов, оставшихся в живых через пять лет после обнаружения подобной опухоли.
«В этой работе мы коррелируем последние клинические, молекулярные и клеточные данные, связанные с мышечно-инвазивным раком мочевого пузыря. Эти данные используются для разработки математической модели заболевания. Конечными целями нашей работы являются, во-первых, идентификация биологических маркеров и конкретных клинических параметров, при помощи которых можно точно определить стадию этой агрессивной формы рака; во-вторых - разработка индивидуальных стратегий её лечения для конкретных пациентов» —Александр Киселёв, профессор МФТИ и ведущий автор новой статьи.
Рак мочевого пузыря возникает по различным причинам - по сути, речь идет о гетерогенных (неоднородных) раковых опухолях, с разными биохимическими и клеточными особенностями, разными генетическими и эпигенетическими профилями, причем, возможно, у одного и того же больного. В зависимости от того, какие именно мутации произошли в ДНК раковой клетки, выросшая из нее опухоль может по-разному реагировать на терапию. Определение точного типа опухоли (профиля) позволяет существенно повысить шансы на успешное лечение и заодно свести к минимуму побочные эффекты.
Определить генетический профиль - значит, установить последовательность нуклеотидных пар в ДНК. Именно она определяет, какие молекулы РНК и белка будут синтезированы. Эпигенетическим профилем называют перечень активных и “молчащих” генов: если участок ДНК или хромосомного белка модифицировать, то часть генов перестанет использоваться.
Молекулярные основы рака
Обычные клетки перерождаются в раковые из-за серии сбоев на генетическом и молекулярном уровне. Ключевую роль в этом играет процесс так называемого эпителиально-мезенхимального перехода - клетки эпителия, образующие слой на поверхности ткани, утрачивают свою нормальную структуру и перестают реагировать на химические сигналы, которые должны ограничивать их деление и/или вызывать самоуничтожение (апоптоз). Такой переход вызывается целым рядом факторов - в частности, синтезом повышенного количества определенных белков.
Для серьезно интересующихся процессом карценогенеза рекомендуется статья “Эпителиально-мезенхимальная пластичность: центральный регулятор опухолевой прогрессии”. Она рассчитана на читательниц и читателей, знакомых с общим курсом биологии в рамках институтской программы или на мотивированных учащихся биологических спецшкол.
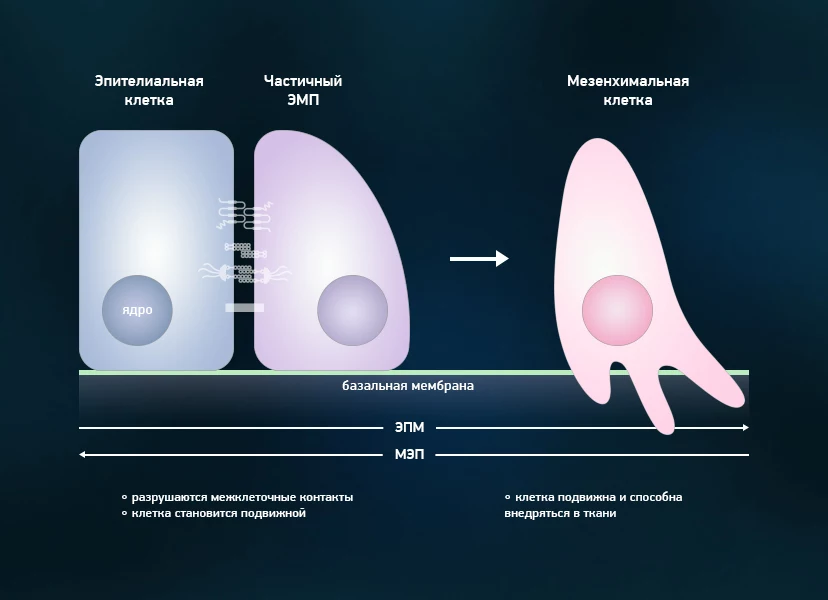
Процесс превращения клетки эпителия в мезенхимальную и обратно. Показано как изменяется форма клетки, и ряд других изменений - например, меняется и внутренняя структура клеток, и контакты между ними. Кроме того, в правой части обозначена такая особенность мезенхимальной клетки, как способность проникать в экстрацеллюлярный матрикс (или, проще говоря, межклеточную среду). Именно повышенная подвижность таких клеток играет на руку распространению рака. Изображение предоставлено пресс-службой МФТИ.
Процесс эпителиально-мезенхимального перехода (ЭМП) напоминает проигранный задом наперед процесс появления обычных клеток: те получаются изначально из стволовых клеток, которые отличаются более широкой специализацией и могут делиться значительно большее число раз. Но если “правильная” стволовая клетка не образует опухоли и необходима для регенерации ткани, то результатом процесса ЭМП может стать появление рака - мезенхимальные клетки перестают реагировать на сигналы окружающих тканей и начинают неудержимый рост. Характерные для данной стадии белки - например, эпителиальный фактор роста или белки семейства Snail - могут помочь обнаружить заболевание в самом начале.
Если следовать отечественной традиции, то называть “раком” можно только опухоли, появившиеся из эпителиальных клеток (впрочем, эта теория прошла несколько стадий эволюции в последние годы, особенно в связи с обнаружением так называемых раковых стволовых клеток или нециркулирующих раковых клеток). Саркома же, например, раком не является, поскольку появляется из клеток соединительной ткани. В англоязычной литературе слово cancer (часто переводимое как “рак”) обозначает все злокачественные новообразования, и там говорят о том, что ЭМП отвечает лишь за большинство случаев рака.
Еще один белок, который играет важнейшую роль в диагностике и лечения рака - белок p53. Он известен тем, что предотвращает превращение здоровой клетки в раковую, запуская процесс самоуничтожения при повреждениях ДНК и различных стрессах (в биохимическом, а не психологическом, значении). Данный механизм эффективно защищает наш организм от злокачественных опухолей, но есть мутации, с которыми он не справляется - речь идет о мутациях в самом гене, кодирующем белок p53. Эти нарушения известны для многих видов рака, они позволяют выявить заболевание, но не дают информации о выборе правильного курса лечения.
Читающим на английском рекомендуем короткое видео о белке p53. Также предполагает как минимум школьную программу по общей биологии.
Наконец, важным признаком агрессивного мышечно-инвазивного рака мочевого пузыря служит изменение концентрации белка Shh. В развивающемся организме этот белок необходим для дифференциации клеток зародыша - но его аномальная экспрессия может быть связана с развитием инвазивного рака.
Буквы Shh обозначают слова sonic hedgehog, что дословно переводится как «сверхзвуковой ежик» и отсылает нас к истории открытия гена. Первым ученые открыли ген, мутация которого покрыла подопытных мушек-дрозофил чем-то вроде ежиных игл — и обозначили его hh, от слова “еж”, hedgehog. Остроумные ученые-генетики добавили к этому описанию слово “Sonic”в честь вымышленного ежа, персонажа игры Sonic theHedgehog. Потом нашли гены desert hedgehog (песчаный еж) и Indian hedgehog (индийский еж). Еще немного о забавных названиях генов, особенно в генетике мух Drosofila Melanogaster.
От знаний белков к диагностике
Проанализировав данные, авторы предложили выстроить подход к лечению рака мочевого пузыря по следующей схеме: сперва все пациенты тестируются на выбранные маркеры развития рака — белки семейства Snail, Shh и другие. Для этого производится биопсия — от опухоли отщипывается небольшой кусочек, затем он обрабатывается веществами, предохраняющими его от разложения - спиртами или формалином. После чего образец заливают парафином и с помощью специального ножа - микротома нарезают тончайшими ломтиками.
Для того чтобы выявить структуру опухоли, срезы “проявляют” реактивами, содержащими модифицированные антитела — белковые вещества, способные связываться с определенными участками ткани — антигенами. Реакции антиген-антитело происходят в нас каждый день, на них основана работа нашего иммунитета. При попадании в организм, например, микробов, специализированные клетки иммунной системы синтезируют антитела, которые их связывают, не дают распространяться. На этом же основан и метод иммуногистохимического исследования. Если в образце присутствует антиген, то он взаимодействует с антителом. Процесс можно сравнить со снятием отпечатков пальцев — поверхность кажется чистой, но после обработки специальным порошком на ней проявляются узоры папиллярных линий.
Чтобы увидеть антитела, к ним добавляют флуоресцентные красители. Изучая обработанные срезы под микроскопом с набором светофильтров, можно выявить наличие раковых клеток, а при большом увеличении появляется и возможность детально рассмотреть расположение исследуемых белков в клетках.
.png)
Для поиска важных маркеров развития опухоли образец ткани также делят на множество частей и раскладывают их по предметному стеклу. Каждый из них подвергают действию определенных антител, поэтому из одного кусочка ткани можно получить данные сразу о многих биомолекулах. Это позволяет в конечном итоге выяснить стадию развития опухоли, предсказав ее агрессивность и инвазивность. Множественность образцов на одном стекле дает возможность заодно выбрать некие индивидуальные маркеры, исходя из истории болезни пациента и сопутствующих заболеваний.
Полученные количественные и качественные данные об экспрессии конкретных биологических молекул (панели маркеров) будут использованы в предложенной авторами математической модели для того, чтобы:
- оценить и, если необходимо, скорректировать начальный клинический диагноз
- оптимизировать выбранный метод лечения, характер и дозы препаратов
- спрогнозировать потенциальные побочные эффекты для каждого конкретного пациента
После окончания терапии должны проводиться дополнительные анализы на выбранную панель маркеров, чтобы оценить достигнутый результат. Авторы считают, что в зависимости от результатов может возникнуть необходимость радикально изменить курс лечения. Подобный подход к ведению истории болезни предоставит необходимые клинические данные для большого числа пациентов, что поможет лечащим врачам усовершенствовать процесс диагностики и подбора индивидуального курса лечения для каждого больного. В условиях, когда дорог каждый день, это — реальная возможность увеличить продолжительность жизни множества пациентов.
https://mipt.ru/newsblog/lenta/matematika_podskazhet_kak_lechit_rak_moch...